




《化学反应与能量变化》化学反应与能量PPT课件(第3课时原电池原理应用化学电源)
第一部分内容:核心素养发展目标
1.知道干电池、充电电池、燃料电池等化学电源的特点。
2.掌握构成电池的要素,了解不同电极材料对电池性能的影响。
3.能正确书写简单化学电源的电极反应式。
... ... ...
化学反应与能量变化PPT,第二部分内容:01设计原电池
知识梳理
1.依据
已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
2.实例
以Zn+H2SO4===ZnSO4+H2↑为例
判断正误
(1)理论上任何氧化还原反应都可设计成原电池( )
(2)原电池中负极上发生氧化反应( )
(3)原电池中正极材料一定发生还原反应( )
(4)原电池中正极材料必须与电解质溶液的某种离子反应( )
理解应用
1.理论上讲,任何自发的氧化还原反应都可以设计成原电池。选择适宜的材料和试剂,请利用反应“Fe+2Fe3+===3Fe2+”设计一个原电池。
回答下列问题:
(1)用双线桥分析上述离子反应,标出电子转移的方向和数目______________;其中氧化反应的半反应可表示为“Fe-2e-===Fe2+”,则还原反应的半反应为_________________。
(2)若设计成原电池
①负极材料是___,选择依据是_________________________________________________;
②正极材料可选用__________,选择依据是______________________________________。
③_________________溶液作电解质。
(3)写出电极反应式
正极:___________________,负极:_______________。
(4)该原电池中电子从________极流出,电解质溶液中的阳离子(Fe3+)移向_____________极。
2.水果简易电池的制作
(1)探究制作水果电池对电极材料的要求(按如图连接)
(已知电流表的指针偏向电子流入的电极)
问题讨论:水果的作用是作:___________。
实验结论:构成原电池的要素有:
①自发的氧化还原反应。
②两个活泼性___________的电极,___________溶液,形成闭合回路。
③根据电极材料判断电极:较活泼金属作___________,不活泼的金属或惰性电极作___________。
(2)探究影响电流效果的因素
【实验1】探究电极材料对电流效果的影响
实验结论:在其他条件相同时,电极材料活泼性差别越大,电流效果越好。
【实验2】探究不同水果对电流效果的影响
实验结论:在其他条件相同时,不同的电解质溶液,电流效果______。
【实验3】探究电极间距对电流效果的影响
实验结论:在其他条件相同时,两电极间距越小,电流效果_______。
归纳总结
水果电池的电流效果与电极材料、水果的种类有关,另外还与两电极间距离以及电极插入水果的深度等因素有关。
跟踪强化
1.右图为番茄制作的水果电池,下列说法正确的是
A.一段时间后,铜片质量减小
B.锌电极发生氧化反应
C.电流由锌通过导线流向铜
D.铜电极是该电池的负极
2.利用离子反应“Fe+2Fe3+===3Fe2+”设计原电池,下列设计不合理的是
①铜片、铁片、FeCl3溶液组成的原电池
②石墨、铁片、Fe(NO3)3溶液组成的原电池
③铁片、锌片、Fe(SO4)3溶液组成的原电池
④银片、铁片、Fe(NO3)2溶液组成的原电池
A.①② B.②③ C.③④ D.②④
3.选择适宜的材料和试剂,请利用反应“Cu+2Ag+===2Ag+Cu2+”设计一个化学电池。
回答下列问题:
(1)负极材料:___;正极材料:__________;电解质溶液:___________。
(2)写出电极反应式
正极:__________________;
负极:________________。
(3)原电池中电子从______极流出,电解质溶液中阴离子流向____极(填“正”或“负”)。
... ... ...
化学反应与能量变化PPT,第三部分内容:02化学电源
知识梳理
1.一次电池
(1)特点:电池放电后______充电(内部的氧化还原反应______逆向进行),如锌锰干电池属于一次电池。
(2)锌锰干电池的构造如图所示:
①锌筒为______,电极反应是__________________。
②石墨棒为______,最终被还原的物质是 ____________。
③NH4Cl糊的作用 __________________。
2.二次电池(充电电池)
(1)特点:二次电池在放电时所进行的____________,在充电时可以 ____________,使电池恢复到放电前的状态。
(2)能量转化:化学能 电能
(3)常见的充电电池:铅酸电池、镍氢电池、锂离子电池。
3.燃料电池
(1)特点:①反应物储存在电池外部,②能量转换效率高、清洁、安全,③供电量易于调节。
(2)燃料电池常用的燃料有:__________、__________、乙醇等。
常用氧化剂:氧气。
判断正误
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)氢氧燃料电池是将热能直接转变为电能( )
(3)充电电池可以无限制地反复充电、放电( )
(4)氢氧燃料电池比氢气直接燃烧发电能量利用率高( )
理解应用
1.1800年伏打用锌片与铜片夹以盐水浸湿的纸片叠成电堆产生了电流,这个装置后来称为伏打电池(也叫伏打电堆),如下图所示。
观察示意图,思考回答下列问题:
(1)负极是:___,电极反应_______________。
(2)正极是:____。
(3)猜测得电子发生还原反应的物质可能是______。
2.铅酸电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程式为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O
按要求回答下列问题:
(1)负极材料是____,正极材料是______,电解质溶液是_______。
(2)工作时,电解质溶液中的H+移向___________极。
(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
(4)当铅蓄电池向外电路提供2 mol e-时,理论上负极板的质量增加___ g。
跟踪强化
1.下列有关电池的叙述不正确的是
A.水果电池是方便实用的家用电池
B.铅蓄电池是一种常用的二次电池
C.氢氧燃料电池是一种高效、无污染的发电装置
D.锌锰干电池工作一段时间后,锌外壳逐渐变薄
2.下列电池工作时,O2在正极得电子的是
3.下列有关锌锰干电池的说法中正确的是
A.锌外壳是负极,石墨碳棒是正极材料
B.在外电路中电子从碳棒流向锌外壳
C.电流从锌流到碳棒上
D.在电池内部阳离子从碳棒向锌片移动
... ... ...
化学反应与能量变化PPT,第四部分内容:03拓展延伸 电极反应式的书写
1.书写电极反应式的原则
电极反应式遵循质量守恒、得失电子守恒及电荷守恒,遵循离子方程式的书写规则,两电极反应式相加得电池总化学(或离子)方程式。
2.书写电极反应式的基本类型
(1)类型一 题目给定原电池的装置图,未给总反应式
①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
②结合电解质判断出还原产物和氧化产物。
③遵循氧化还原反应离子方程式配平原则,写出电极反应式。(注意:电极产物能否与电解质溶液共存,如铅蓄电池的负极铅失电子变为Pb2+,但Pb2+与硫酸溶液中的SO 不共存,因而负极电极反应式为Pb-2e-+SO ===PbSO4)
④将两电极反应式相加(注意两极得失电子数相等)可得电池总反应式。
(2)类型二 题目中给出原电池的总反应式
①分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应即为负极反应。
②当氧化剂、还原剂、氧化产物、还原产物由多种元素组成时,还应考虑电解质是否参与了反应。
③若有一个电极反应式较难写出,可先写出较易写出的电极反应式,然后再用总反应式减去该电极反应式即得到另一电极反应式。
理解应用
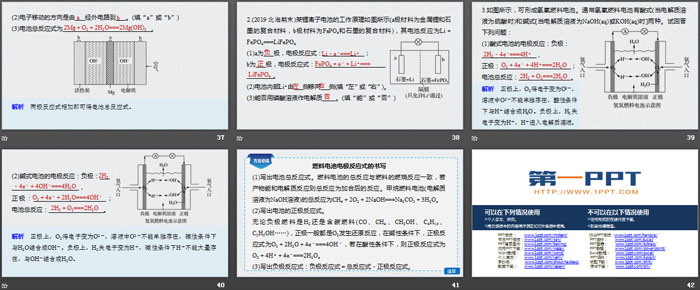
1.一种镁-空气电池装置如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。
(1)负极电极反应式___________________________,正极电极反应式____________________。
(2)电子移动的方向是由___经外电路到___。(填“a”或“b”)
(3)电池总反应式为____________________________。
2.(2019·北海期末)某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料,b极材料为FePO4和石墨的复合材料),其电池反应为Li+FePO4===LiFePO4
(1)a为___极,电极反应式:_____________;b为___极,电极反应式:______________________________。
(2)电池内部Li+由___侧移向___侧(填“左”或“右”)。
(3)能否用磷酸溶液作电解质____。(填“能”或“否”)
3.如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
(1)酸式电池的电极反应:负极:_________________,
正极:______________________;
电池总反应:________________。
(2)碱式电池的电极反应:负极:________________________,
正极:_______________________;电池总反应:_________________。
方法总结
燃料电池电极反应式的书写
(1)写出电池总反应式。燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应则总反应为加合后的反应。甲烷燃料电池(电解质溶液为NaOH溶液)的总反应为CH4+2O2+2NaOH===Na2CO3+3H2O。
(2)写出电池的正极反应式。
无论负极燃料是H2还是含碳燃料(CO、CH4、CH3OH、C4H10、C2H5OH……),正极一般都是O2发生还原反应,在碱性条件下,正极反应式为O2+2H2O+4e-===4OH-,若在酸性条件下,则正极反应式为O2+4H++4e-===2H2O。
(3)写出负极反应式:负极反应式=总反应式-正极反应式。
关键词:人教版高中化学必修二PPT课件免费下载,化学反应与能量变化PPT下载,化学反应与能量PPT下载,原电池原理应用化学电源PPT下载,.PPT格式;











